
- Autor Stanley Ellington ellington@answers-business.com.
- Public 2023-12-16 00:22.
- Naposledy zmenené 2025-01-22 16:13.
Za účelom prevod na IND , noví aj bývalí vlastníci sú povinní predložiť informácie FDA. To zahŕňa list od bývalého vlastníka, v ktorom sa uvádza, že všetky práva na aplikáciu boli prenesené na nového vlastníka a že nový vlastník dostane alebo dostal komplet IND záznam.
Ako potom podám IND?
Podanie IND vyžaduje vyplnenie 3 súborov formulárov: 1 s podrobným popisom štúdie (formulár 1571 FDA), 1. poskytuje informácie o skúšateľovi a mieste štúdie (formulár FDA 1572) a 1. osvedčuje, že štúdia je registrovaná v národnej databáze klinických skúšok (FDA Formulár 3674).
Okrem toho, čo je NDA a IND? The NDA aplikácia je prostriedok, prostredníctvom ktorého sponzori liekov formálne navrhujú, aby FDA schválil nový liek na predaj a marketing v USA. IND ) stať sa súčasťou NDA.
Ak vezmeme do úvahy toto, čo je schválenie IND?
Výskumný nový liek amerického Úradu pre kontrolu potravín a liečiv ( IND ) program je prostriedok, ktorým farmaceutická spoločnosť získa povolenie na začatie klinických skúšok na ľuďoch a na prepravu experimentálneho lieku cez štátne hranice (zvyčajne klinickým výskumníkom) predtým, ako sa dostane na trh žiadosť o liek
Vyžaduje sa ind?
Vo všeobecnosti platí, že skúšaný nový liek ( IND ) aplikácia je požadovaný keď je hlavným zámerom akejkoľvek klinickej výskumnej štúdie získať informácie, ktoré navrhujú použitie alebo hodnotenie bezpečnosti a/alebo účinnosti neschváleného lieku.
Odporúča:
Ako prevediem kubické stopy na štvorcové stopy?

Kubické stopy = štvorcové stopy × hĺbka. Čiže: 20 × 0,25 = 5. Máme celkom: 5 kubických stôp
Ako prevediem svoj rotačný telefón na digitálny?

Ako môžem použiť rotačný telefón na digitálnej linke? Kúpte si radový prevodník s pulzným vytáčaním na tónový. Pripojte kábel prevodníka k rotačnému telefónu. Pripojte jeden koniec telefónneho kábla k výstupu konvertora a potom pripojte druhý koniec telefónneho kábla k telefónnemu konektoru alebo digitálnemu zariadeniu. Pozrite si príručku, kde nájdete pokyny špecifické pre jednotku
Ako prevediem Docker na Kubernetes?
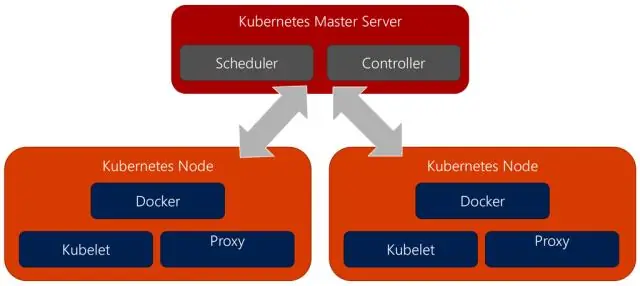
Použite Kompose Prejdite do adresára, ktorý obsahuje váš docker-compose. yml súbor. Spustite príkaz kompose up na nasadenie priamo do Kubernetes alebo namiesto toho preskočte na ďalší krok a vygenerujte súbor na použitie s kubectl. Ak chcete previesť docker-compose
Ako prevediem svoju licenciu na nehnuteľnosti na iného makléra na Floride?

Ak chcete prejsť od jedného PRO brokera k druhému, postupujte podľa týchto krokov: Váš nový broker musí preniesť vašu licenciu do svojej kancelárie v rámci DBPR na MyFloridaLicense.com. Overte, že vaša licencia bola prevedená, vyhľadaním licencie na MyFloridaLicense.com. Vyplňte formulár PRO Transfer
Ako prevediem inštalatérske práce cez čapy?

Nižšie je uvedený návod, aby ste sa uistili, že váš projekt ide tak, ako má. Krok 1 - Získajte správne potrubia. Krok 2 - Precvičte si spájkovanie. Krok 3 - Plánovanie potrubia. Krok 4 - Nainštalujte odtokové potrubie. Krok 5 - Pripravte kolíky. Krok 6 - Nainštalujte plast. Krok 7 – Odvzdušnite odpadové potrubia. Krok 8 - Spustite potrubia
